—Cómo y por qué las pruebas de mutagenicidad se convirtieron en parte de la ciencia y la regulación ambiental desde la década de 1970.—
La prueba de Ames fue desarrollado a principios de la década de 1970 por Bruce N. Ames (1928-2024) para detectar los productos químicos que causan mutaciones genéticas en bacterias. Hace uso de varias cepas mutantes de Salmonella typhimurium que pierden la capacidad de sintetizar histidina, un aminoácido esencial. Estas cepas normalmente no pueden crecer en medios mínimos, es decir, en aquellos cultivos que contienen los nutrientes básicos para el crecimiento de una colonia. Ahora bien, la presencia de un producto químico mutágeno propicia la formación de mutaciones que restauran la capacidad de la célula bacteriana para producir su propia histidina. La prueba original examinaba el crecimiento de las cepas de Salmonella en una placa de Petri, el recipiente en el que habitualmente se realizan las pruebas de cultivos microbianos, de modo que cada colonia de células representaba una mutación. En la siguiente imagen se muestra un ejemplo de la prueba de Ames.
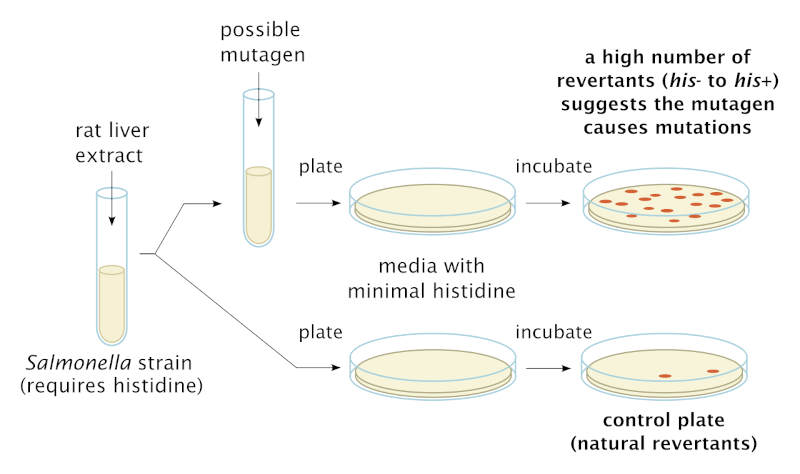
Diagrama esquemático que muestra el procedimiento de la prueba de Ames utilizando cepas mutantes personalizadas de Salmonella typhimurium que requieren histidina. Wikimedia.
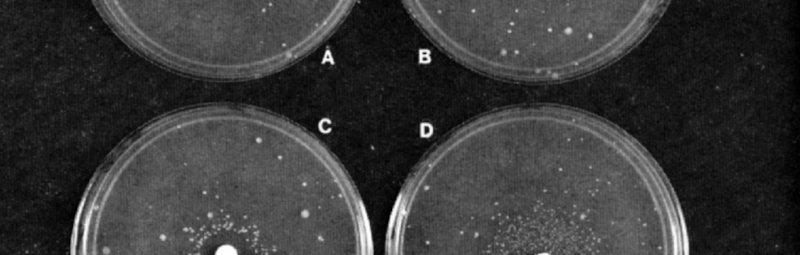
Dado que existe una tasa de mutación de fondo de origen natural, para obtener un resultado positivo en el ensayo de Ames es necesaria la aparición de más colonias bacterianas que las que aparecen en la placa de control, es decir, aquella en la que no se ha colocado la sustancia química estudiada. La siguiente imagen muestra los resultados de la prueba de Ames en los que la sustancia de prueba se agrega a través de un disco de papel sobre el agar (un medio de cultivo habitual) de la placa de Petri. Ames agregó al ensayo un extracto de hígado de rata con enzimas conocidas por activar muchas sustancias potencialmente carcinógenas en humanos. De este modo, las células de Salmonella quedaban expuestas a intermediarios metabólicos de la sustancia analizada, tal y como se generarían en el cuerpo de los mamíferos. En general, un resultado positivo en el ensayo de Ames se toma como una indicación de que la sustancia química causa mutaciones en animales, incluidos los humanos.

Imágenes de las pruebas de Ames para (A) revertidos espontáneos y exposición a (B) furilfuramida, (C) alfatoxina B1 y (D) 2-aminofluoreno. Los compuestos mutagénicos en B, C y D se aplicaron al disco de filtro de 6 mm en el centro de cada placa. Cada placa de Petri contiene células de la cepa del probador en una fina capa de agar superior. La cepa microbiana empleada aquí fue “TA98”, una cepa producida agregando un factor de transferencia de resistencia a una cepa del probador de Salmonella, el mutante “hisD3052”, que puntúa mutaciones de cambio de marco, como las indicadas en el texto. Las placas C y D contienen, además, un sistema de activación microsomal hepático extraído de ratas. Los revertidos espontáneos o los inducidos por los compuestos ensayados antes mencionados, cada uno de los cuales refleja una mutación particular, aparecen en un anillo como manchas alrededor del disco de papel. Fuente: Ames, McCann & Yamasaki 1975, p. 358. ResearchGate.
La prueba de Ames fue una de las docenas de pruebas rápidas de laboratorio desarrolladas para identificar agentes que potencialmente dañan el ADN. De hecho, la prueba de Ames solamente identifica cambios en un par de bases del ADN, en particular lo que se denomina mutaciones de cambio de marco de lectura. La prueba utiliza varias cepas porque cada una registra un cambio mutacional diferente en el ADN a nivel de sus bases individuales (adenina, timina, guanina o citosina). Se desarrollaron otras pruebas de mutagenicidad para identificar alteraciones genéticas a mayor escala, tales como inserciones, deleciones o aberraciones cromosómicas. El término genotoxicidad se refiere a todos estos cambios mutacionales y puede incluir alteraciones epigenéticas, es decir, cambios relevantes en la expresión de los genes, tal y como se ilustra en la figura siguiente.
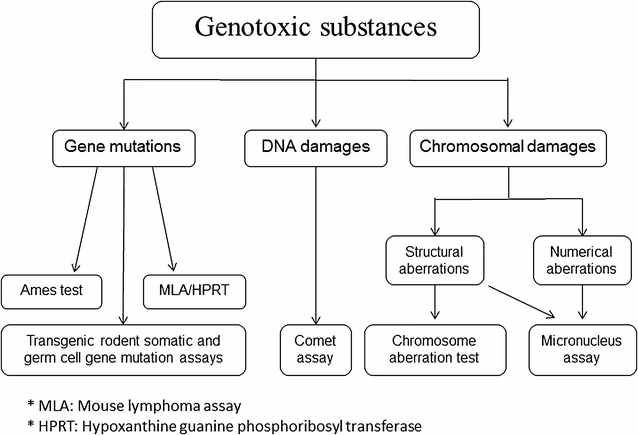
Diagrama esquemático que representa los métodos de ensayo más comunes utilizados para detectar sustancias genotóxicas. La prueba de Ames está bajo en la sección de mutaciones genéticas en el extremo izquierdo. Journal of Translational Medicine.
En la década de 1970, las agencias gubernamentales de Estados Unidos, como la Oficina de Alimentos y Medicamentos (FDA) y la Agencia de Protección Ambiental (EPA), comenzaron a desarrollar pautas para las pruebas de mutagenicidad de los nuevos productos que eran sometidos a su autorización bajo las normativas correspondientes en cada caso. Se han realizado numerosas modificaciones del ensayo de Ames desde que se introdujo por primera vez, tales como el crecimiento de células en tubos de cultivo o el recuento automatizado de colonias. Una prueba de reversión genética similar —también llamada de genética inversa porque se altera el ADN para estudiar su expresión— fue desarrollada mediante el uso de la bacteria Escherichia coli y, en ocasiones, también se la conoce como «prueba de Ames», dado que funciona según el mismo principio. Aunque estas pruebas simples con bacterias se han complementado con pruebas de genotoxicidad con células animales, la prueba de Ames sigue siendo el método más utilizado para determinar la mutagenicidad. Hasta el día de hoy, los datos de las pruebas de Ames se envían normalmente a las agencias reguladoras que requieren datos de toxicidad para la autorización de nuevos productos químicos.
La introducción de la prueba de Ames para identificar sustancias químicas que causan mutaciones respondió a las crecientes preocupaciones de la sociedad estadounidense acerca de la presencia de sustancias tóxicas en alimentos, medicamentos, productos de consumo y el medio ambiente. A lo largo del siglo XX, la investigación de laboratorio y las observaciones de enfermedades en el medio laboral habían ofrecido indicios de que los productos químicos industriales estaban relacionados de algún modo con una mayor incidencia del cáncer en humanos, una grave enfermedad que parecía estar en aumento.
La conocida como enmienda Delaney (Delaney Amendment) de 1958 introducida por la FDA prohibió el uso de aditivos alimentarios cancerígenos. El libro Primavera silenciosa (Silent Spring), publicado por Rachel Carson en 1962, alarmó al público norteamericano sobre el problema, empleando crudas descripciones del modo en que los productos químicos sintéticos estaban destruyendo la vida natural, al mismo tiempo que suponían serias amenazas para la salud humana. A finales de la década de 1950 y principios de la siguiente, la creciente oposición pública a los ensayos de armas atómicas, debido a los peligros de la lluvia radiactiva, condujo a los gobiernos de Estados Unidos, la Unión Soviética y el Reino Unido a firmar un tratado de no proliferación de las pruebas atómicas atmosféricas. En Estados Unidos, la continua preocupación pública por el cáncer producido por la radiactividad llevó a una fuerte oposición contra las centrales de energía nuclear. El movimiento ecologista de la década de 1970, catalizado por el libro de Carson, se basó en la contestación pública a las pruebas de armas atómicas, al mismo tiempo que se prestaba atención creciente a los problemas de los plaguicidas y los productos contaminantes.
En respuesta a estas preocupaciones de la ciudadanía y al crecimiento del movimiento ecologista, el gobierno federal estadounidense se decidió a combatir el cáncer producido por productos químicos, tratándolo como un problema fundamental de salud pública. A pesar de que la toxicidad había sido entendida tradicionalmente en términos de efectos inmediatos (o agudos) en un organismo, la comunidad científica empezó a preocuparse cada vez más por la llamada toxicidad crónica, es decir, por los efectos a largo plazo de la exposición a productos químicos, incluso cuando se producía en dosis bajas. En 1968, el Instituto Nacional del Cáncer (NCI) de Estados Unidos lanzó un “plan para estudiar la carcinogénesis química y la prevención del cáncer”. Durante los años siguientes, este instituto publicó estudios que estimaban que hasta el 90% de los cánceres en humanos se debían a productos carcinógenos liberados en el ambiente. Según se pensaba, los carcinógenos producían cáncer al inducir mutaciones de ADN en las células somáticas, es decir, aquellas que constituyen la mayor parte del cuerpo humano (con la excepción de óvulos y espermatozoides). Esta teoría de las causas del cáncer fue una de las muchas que se formularon y circulaban a principios del siglo XX. Sin embargo, durante las décadas de 1950 y 1960, el incremento de los saberes acerca de los peligros para la salud de las radiaciones ionizantes, sobre todo las producidas por materiales radioactivos, proporcionó nuevas pruebas para apoyarla. Los radiobiólogos, a menudo financiados por la Comisión de Energía Atómica de Estados Unidos, demostraron fehacientemente que ningún nivel de radiación ionizante era completamente inocuo. Incluso las exposiciones a dosis bajas podían propiciar la aparición de mutaciones con capacidad para producir cáncer. Además, el “modelo de carcinogénesis de múltiples etapas”, que fue propuesto por Peter Armitage y Richard Doll en 1954, abordó el cáncer como producto de no solo de uno, sino de varios eventos celulares. Estos eventos podían ser mutaciones, como las inducidas por la radiación o por contaminantes químicos.
Si el cáncer podía entenderse como una enfermedad producida por mutaciones, entonces resultaba lógico considerar a los productos carcinógenos como los agentes causantes de tales mutaciones, de ahí que recibieran el nombre de mutágenos. Fue esta línea de pensamiento la que inspiró a Bruce Ames, bioquímico de la Universidad de California (Berkeley), para desarrollar su sencillo ensayo de laboratorio mediante cepas modificadas de la bacteria Salmonella typhimirium. A mediados de la década de 1970, su laboratorio analizó una muestra de 300 sustancias químicas de uso común y llegó a la conclusión de que el 90% de los mutágenos de la Salmonella también eran carcinógenos de roedores, así como que el 89% de los productos carcinógenos probados en animales también eran mutágenos bacterianos. En 1975, Bruce Ames y sus colaboradores identificaron muchos tintes para el cabello como potencialmente mutagénicos, un hallazgo que fue ampliamente descrito en los medios de comunicación de la época. Además, Arlene Blum y Bruce Ames también investigaron el carácter mutagénico de un producto retardante de llama agregado en esos años a los pijamas de los niños con la finalidad de cumplir con los estándares de seguridad respecto a la inflamabilidad de los tejidos. Posteriormente se descubrió que esta sustancia —denominada habitualmente tris por simplificación de su nombre químico: fosfato de tris-1,3-dicloro-2-propilo (TDCCP)— causaba cáncer en roedores. Cuando la Comisión de Seguridad de Productos del Consumidor de Estados Unidos prohibió esta sustancia en la ropa para niños empleó como prueba los resultados de mutagenicidad obtenidos mediante el ensayo de Ames.

Fotografía de Bruce N. Ames en 2009. Wikimedia.
Como indica el ejemplo del tris, la prueba rápida y económica diseñada por Ames se convirtió en una herramienta de gran valor para la toxicología, la regulación de los tóxicos y las ciencias ambientales. También las compañías farmacéuticas lo adoptaron para identificar medicamentos potencialmente cancerígenos. Desde 1962, la FDA requirió pruebas rigurosas y anteriores a la comercialización para aprobar todos los medicamentos nuevos. Identificar posibles productos carcinógenos antes de realizar las costosas pruebas en animales era, sin duda, un procedimiento ventajoso para la industria. Además, la EPA y la FDA comenzaron a exigir datos de la prueba Ames y de otras pruebas de mutagenicidad similares para los nuevos pesticidas y los aditivos alimentarios antes de su aprobación para el mercado. La comunidad científica y el personal funcionario del gobierno tenían la esperanza de que el uso generalizado del ensayo de Ames permitiría la detección fiable y la regulación exhaustiva de todos los productos químicos —ya había cerca de 60.000 en el mercado a mediados de la década de los setenta— para disminuir o incluso eliminar la incidencia de cáncer por la exposición ambiental a estas sustancias químicas peligrosas.
Este sueño tan prometedor nunca llegó a cumplirse. Un número creciente de productos químicos fueron ensayados y dieron positivo como mutágenos, muchos más de lo esperado inicialmente, incluyendo muchas sustancias de origen natural. Además, las acciones lobbísticas de la industria consiguieron impedir la inclusión de un requisito de pruebas de mutagenicidad para nuevos productos químicos en la Ley de Control de Sustancias Tóxicas (TSCA) de Estados Unidos aprobada en 1976. A pesar de que esta normativa estaba repleta del término “pruebas”, en los años que siguieron a su promulgación la mayoría de las compañías químicas no informaron en los informes previos a la comercialización sobre la mutagenicidad de sus productos, ni tampoco ofrecieron resultados de otros ensayos similares con indicios relevantes acerca de la toxicología y los peligros para la salud humana de sus productos. Por otra parte, las agencias federales que supervisan los productos químicos (como la EPA) se encargaron de proteger la información comercial confidencial. Las empresas fueron habilidosas en considerar los datos de toxicidad como parte de esa información confidencial, lo que les permitía evitar su difusión pública. En 1997, la Fundación para la Defensa del Medio Ambiente (Environmental Defense Fund), una organización creada treinta años antes por una coalición de científicos y abogados para combatir los efectos del DDT, informó que se carecía de información pública acerca de las pruebas de toxicidad para más de dos terceras partes de los 3.000 productos químicos más vendidos en Estados Unidos.
En la década de 1980, la comprensión del cáncer como una enfermedad desencadenada por mutaciones, que había sido tan central para las políticas de salud ambiental anteriores, se transformó sustancialmente hasta situarse en un marco disciplinar cada vez más relacionado con la genética. El proyecto del Genoma Humano intensificó la búsqueda de mutaciones asociadas con un mayor riesgo de cáncer, como las ocurridas en los genes BRCA y que podían asociarse con el cáncer de mama. Como reflejo de estas tendencias, la prevención del cáncer pasó a centrarse en las fuentes de riesgo en los estilos de vida individuales, a menudo a expensas de la atención debida a los efectos de las exposiciones a tóxicos ambientales de carácter involuntario. La comunidad médica y el personal encargado de las políticas de salud pública afrontaron el cáncer, de modo creciente, en términos de factores de riesgo. Incluso las personas especialistas en salud ambiental adoptaron este cambio de perspectiva, en parte gracias a las nuevas posibilidades abiertas por la nueva toxicogenómica que permitía estudiar las variedades genéticas particulares de los individuos más susceptibles a la acción de los productos tóxicos.
Los opositores a la regulación industrial movilizaron con destreza estos nuevos modelos biológicos de la carcinogénesis, especialmente los relacionados con la predisposición genética, para desviar la atención y evitar la posible culpabilidad de las sustancias contaminantes y de los productos químicos comerciales como causas potenciales del cáncer en humanos. Al mismo tiempo, se ha producido un cambio en los fundamentos explicativos de los efectos tóxicos de los productos químicos industriales. Este cambio se ha producido en parte por el creciente interés por los disruptores endocrinos, unas sustancias que pueden producir, incluso en cantidades pequeñas, diversos tipos de cáncer, sin que su mecanismo de acción esté relacionado con la mutación.
El repaso por los primeros años de uso de la prueba de Ames en Estados Unidos revela la forma en que la comunidad científica y las autoridades reguladoras intentaron utilizar la ciencia para proteger la salud humana y el medio ambiente, empleando los resultados de esta prueba para controlar la circulación de los productos químicos tóxicos. La historia también muestra que la industria química luchó contra los nuevos requisitos regulatorios, a menudo a través de lo que Robert Proctor ha llamado trade association science, es decir, ciencia al servicio de intereses comerciales. En este sentido, los debates sobre la prevención del cáncer mediante el control de productos químicos potencialmente mutagénicos formaban parte de una controversia mucho más amplia sobre los costes ambientales de la industrialización, incluyendo en ellos también problemas globales como el cambio climático producido por una larga dependencia de los combustibles fósiles. En definitiva, el repaso de la mejora de la protección del medio ambiente depende en gran medida de la determinación de lo que se considera (o no) como ciencia, qué personas tienen acceso a estos saberes y el modo en que este conocimiento sirve (o no) para iluminar la toma de decisiones en materia de regulación de productos peligrosos. Se ha visto en este trabajo que las pruebas estandarizadas son elementos esenciales, de gran relevancia para esta cuestión, pero no son tenidas suficientemente en cuenta, tanto en las ciencias ambientales como en los procesos de regulación.
Angela N. H. Creager
Princeton University
*Traducción: José Ramón Bertomeu Sánchez
Cómo citar este artículo:
Creager, Angela N. H. La prueba de Ames. Sabers en acció, 2025-07-09. https://sabersenaccio.iec.cat/es/la-prueba-de-ames/.
Para saber más
Puedes ampliar la información con la bibliografía y recursos disponibles.
Lecturas recomendadas
Boudia, Soraya, Angela N. H. Creager, Scott Frickel, Nathalie Jas, Carsten Reinhardt, and Jody A. Roberts. 2022. Residues: Thinking Through Chemical Environments. Rutgers University Press.
Oreskes, Naomi and Erik M. Conway. 2010. Merchants of Doubt: How a Handful of Scientists Obscured the Truth on Issues from Tobacco Smoke to Global Warming. Bloomsbury.
Proctor, Robert. 1995. Cancer Wars: How Politics Shapes What We Know & Don’t Know about Cancer. Basic Books.
Estudios
Boudia, Soraya, and Jas, Nathalie. 2013. Toxicants, Health and Regulation Since 1945. London: Pickering & Chatto.
Brickman, Ronald, Sheila Jasanoff, and Thomas Ilgen. 1985. Controlling Chemicals: The Politics of Regulation in Europe and the United States. Cornell University Press.
Creager, Angela N. H. 2014. “The Political Life of Mutagens: A History of the Ames Test,” in Powerless Science? Science and Politics in a Toxic World, edited by Soraya Boudia and Nathalie Jas, 46–64. Berghahn Books.
Creager, Angela N. H. 2021. “To Test or Not to Test: Tools, Rules, and Corporate Data in U.S. Chemicals Regulation,” Science, Technology & Human Values 46, no. 5: 975–97 https://doi.org/10.1177/01622439211013373
Demortain, David. 2020. The Science of Bureaucracy: Risk Decision Making and the US Environmental Protection Agency. MIT Press.
Frickel, Scott. 2004. Chemical Consequences: Environmental Mutagens, Scientist Activism, and the Rise of Genetic Toxicology. Rutgers University Press.
Langston, Nancy. 2010. Toxic Bodies: Hormone Disruptors and the Legacy of DES. Yale University Press.
Markowitz, Gerald, and Rosner, David. 2002. Deceit and Denial: The Deadly Politics of Industrial Pollution. University of California Press.
Murphy, Michelle. 2006. Sick Building Syndrome and the Problem of Uncertainty: Environmental Politics, Technoscience, and Women Workers. Duke University Press.
Sellers, Christopher. 1997. Hazards of the Job: From Industrial Disease to Environmental Health Science. University of North Carolina Press.
Shostak, Sara. 2013. Exposed Science: Genes, the Environment, and the Politics of Population Health. University of California Press.
Vogel, Sarah A. 2013. Is It Safe? BPA and the Struggle to Define the Safety of Chemicals. University of California Press.
Fuentes
Ames, Bruce N. 1973. “Carcinogens are Mutagens: Their Detection and Classification.” Environmental Health Perspectives 6: 115–18.
Ames, Bruce N., Harold O. Kammen, and Edith Yamasaki. 1975. “Hair Dyes Are Mutagenic: Identification or a Variety of Mutagenic Ingredients.” Proceedings of the National Academy of Sciences, USA 72, no. 6: 2423–27.
Ames, Bruce N., Joyce McCann, and Edith Yamasaki. 1975. “Methods for Detecting Carcinogens and Mutagens with the Salmonella/Mammalian-Microsome Mutagenicity Test.” Mutation Research 31: 347–64.
Carson, Rachel. 1962. Silent Spring. Houghton Mifflin.
Environmental Defense Fund. 1997. Toxic Ignorance: The Continuing Absence of Basic Health Testing for Top-selling Chemicals in the United States. https://www.edf.org/sites/default/files/243_toxicignorance_0.pdf
McCann, Joyce, Edmund Choi, Edith Yamasaki, and Bruce N. Ames. 1975. “Detection of Carcinogens as Mutagens in the Salmonella/microsome Test: Assay of 300 Chemicals.” Proceedings of the National Academy of Sciences, USA 72, no. 12: 5135–39.
Páginas de internet y otros recursos
The (Un)making of Environmental Carcinogens: https://unmakingenvironmentalcarcinogens.princeton.edu
Distillations podcast on the Ames test: https://sciencehistory.org/stories/distillations-pod/the-ames-test/