—Com i per què les proves de mutagenicitat van esdevenir part de la ciència i la regulació ambiental des de la dècada del 1970.—
El test d’Ames va ser desenvolupat a principis de la dècada del 1970 per Bruce N. Ames (1928-2024) per a detectar els productes químics que causen mutacions genètiques en bactèries. Fa ús de diverses soques mutants de Salmonella typhimurium que perden la capacitat de sintetitzar histidina, un aminoàcid essencial. Aquestes soques normalment no poden créixer en medis mínims, és a dir, en aquells cultius que contenen els nutrients bàsics per al creixement d’una colònia. Ara bé, la presència d’un producte químic mutagen propicia la formació de mutacions que restauren la capacitat de la cèl·lula bacteriana per a produir la seua pròpia histidina. La prova original examinava el creixement de les soques de Salmonella en una placa de Petri, el recipient en què habitualment es realitzen les proves de cultius microbians, de manera que cada colònia de cèl·lules representava una mutació. A la següent imatge es mostra un exemple del test d’Ames.
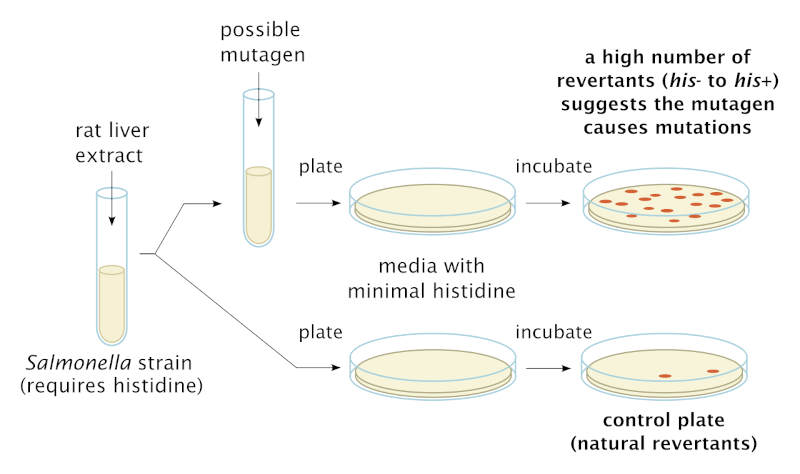
Diagrama esquemàtic que mostra el procediment del test d’Ames utilitzant soques mutants personalitzades de Salmonella typhimurium que requereixen histidina. Wikimedia.
Atès que existeix una taxa de mutació de fons d’origen natural, per a obtenir un resultat positiu al test d’Ames és necessària l’aparició de més colònies bacterianes que les que apareixen a la placa de control, és a dir, aquella en la qual no s’ha col·locat la substància química estudiada. La següent imatge mostra els resultats del test d’Ames en els quals la substància de prova s’agrega a través d’un disc de paper sobre l’agar (un medi de cultiu habitual) de la placa de Petri. Ames va agregar a l’assaig un extracte de fetge de rata amb enzims coneguts per activar moltes substàncies potencialment carcinògenes en humans. D’aquesta manera, les cèl·lules de Salmonella quedaven exposades a intermediaris metabòlics de la substància analitzada, tal com es generarien en el cos dels mamífers. En general, un resultat positiu al test d’Ames es pren com una indicació que la substància química causa mutacions en animals, inclosos els humans.

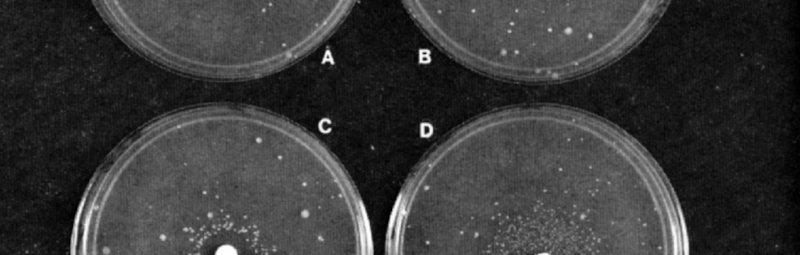
Imatges dels test d’Ames per a (A) revertits espontanis i exposició a (B) furilfuramida, (C) alfatoxina B1 i (D) 2-aminofluorè. Els compostos mutagènics en B, C i D es van aplicar al disc de filtre de 6 mm al centre de cada placa. Cada placa de Petri conté cèl·lules de la soca del provador en una fina capa d’agar superior. La soca microbiana emprada ací va ser “TA98”, una soca produïda agregant un factor de transferència de resistència a una soca del provador de Salmonella, el mutant “hisD3052”, que puntua mutacions de canvi de marc, com les indicades al text. Les plaques C i D contenen, a més, un sistema d’activació microsomal hepàtic extret de rates. Els revertits espontanis o els induïts pels compostos assajats abans esmentats cadascun dels quals reflecteix una mutació particular, apareixen en un anell com a taques al voltant del disc de paper. Font: Ames, McCann & Yamasaki 1975, p. 358. ResearchGate.
El test d’Ames va ser una de les dotzenes de proves ràpides de laboratori desenvolupades per a identificar agents que potencialment danyen l’ADN. De fet, el test d’Ames només identifica canvis en un parell de bases de l’ADN, en particular el que s’anomena mutacions de canvi en el marc de lectura. La prova utilitza diverses soques perquè cadascuna registra un canvi mutacional diferent a l’ADN a nivell de les seues bases individuals (adenina, timina, guanina o citosina). Es van desenvolupar altres proves de mutagenicitat per a identificar alteracions genètiques a major escala, com ara insercions, delecions o aberracions cromosòmiques. El terme genotoxicitat es refereix a tots aquests canvis mutacionals i pot incloure alteracions epigenètiques, és a dir, canvis rellevants en l’expressió dels gens, tal com s’il·lustra a la figura següent.
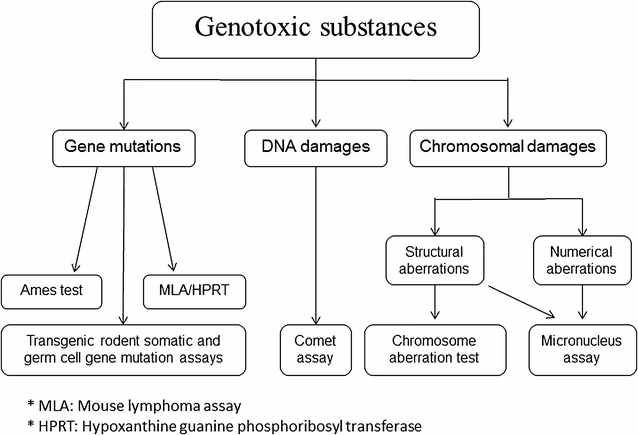
Diagrama esquemàtic que representa els mètodes d’assaig més comuns utilitzats per a detectar substàncies genotòxiques. El test d’Ames està sota la secció de mutacions genètiques a l’extrem esquerre. Journal of Translational Medicine.
A la dècada del 1970, les agències governamentals dels Estats Units, com l’Oficina d’Aliments i Medicaments (FDA) i l’Agència de Protecció Ambiental (EPA), van començar a desenvolupar pautes per a les proves de mutagenicitat dels nous productes que eren sotmesos a la seua autorització sota les normatives corresponents en cada cas. S’han realitzat nombroses modificacions del test d’Ames des que es va introduir per primera vegada, com ara el creixement de cèl·lules en tubs de cultiu o el recompte automatitzat de colònies. Una prova de reversió genètica similar —també anomenada de genètica inversa perquè s’altera l’ADN per a estudiar-ne l’expressió— va ser desenvolupada mitjançant l’ús de la bactèria Escherichia coli i, en ocasions, també és coneguda com a “test d’Ames”, atès que funciona segons el mateix principi. Encara que aquestes proves simples amb bactèries s’han complementat amb proves de genotoxicitat amb cèl·lules animals, el test d’Ames segueix sent el mètode més utilitzat per a determinar la mutagenicitat. Fins al dia d’avui, les dades dels test d’Ames s’envien normalment a les agències reguladores que requereixen dades de toxicitat per a l’autorització de nous productes químics.
La introducció del test d’Ames per a identificar substàncies químiques que causen mutacions va respondre a les creixents preocupacions de la societat estatunidenca sobre la presència de substàncies tòxiques en aliments, medicaments, productes de consum i el medi ambient. Al llarg del segle XX, la recerca de laboratori i les observacions de malalties en el medi laboral havien mostrat indicis que els productes químics industrials estaven relacionats d’alguna manera amb una major incidència del càncer en humans, una greu malaltia que semblava estar en augment.
La coneguda com a esmena Delaney (Delaney Amendment) de 1958 introduïda per la FDA va prohibir l’ús d’additius alimentaris cancerígens. El llibre Primavera silenciosa (Silent Spring), publicat per Rachel Carson el 1962, va alarmar el públic nord-americà sobre el problema, emprant crues descripcions de la manera en què els productes químics sintètics estaven destruint la vida natural, alhora que suposaven serioses amenaces per a la salut humana. A finals de la dècada del 1950 i principis de la següent, la creixent oposició pública als assajos d’armes atòmiques, degut als perills de la pluja radioactiva, va conduir els governs dels Estats Units, la Unió Soviètica i el Regne Unit a signar un tractat de no proliferació de les proves atòmiques atmosfèriques. Als Estats Units, la contínua preocupació pública pel càncer produït per la radioactivitat va portar a una forta oposició contra les centrals d’energia nuclear. El moviment ecologista de la dècada del 1970, catalitzat pel llibre de Carson, es va basar en la contestació pública a les proves d’armes atòmiques, alhora que es prestava atenció creixent als problemes dels plaguicides i els productes contaminants.
En resposta a aquestes preocupacions de la ciutadania i al creixement del moviment ecologista, el govern federal estatunidenc es va decidir a combatre el càncer produït per productes químics, tractant-lo com un problema fonamental de salut pública. A pesar que la toxicitat havia estat entesa tradicionalment en termes d’efectes immediats (o aguts) en un organisme, la comunitat científica va començar a preocupar-se cada cop més per l’anomenada toxicitat crònica, és a dir, pels efectes a llarg termini de l’exposició a productes químics, inclús quan es produïa en dosis baixes. El 1968, l’Institut Nacional del Càncer (NCI) dels Estats Units va llançar un “pla per a estudiar la carcinogènesi química i la prevenció del càncer”. Durant els anys següents, aquest institut va publicar estudis que estimaven que fins el 90% dels càncers en humans es devien a productes carcinògens alliberats a l’ambient. Tal com es pensava, els carcinògens produïen càncer en induir mutacions d’ADN a les cèl·lules somàtiques, és a dir, aquelles que constitueixen la major part del cos humà (amb l’excepció d’òvuls i espermatozoides). Aquesta teoria de les causes del càncer va ser una de les moltes que es van formular i circulaven a principis del segle XX. Tanmateix, durant les dècades del 1950 i 1960, l’increment dels sabers sobre els perills per a la salut de les radiacions ionitzants, sobretot les produïdes per materials radioactius, va proporcionar noves proves per a confirmar-la. Els radiobiòlegs, sovint finançats per la Comissió d’Energia Atòmica dels Estats Units, van demostrar fefaentment que cap nivell de radiació ionitzant era completament innocu. Inclús les exposicions a dosis baixes podien propiciar l’aparició de mutacions amb capacitat per a produir càncer. A més, el “model de carcinogènesi de múltiples etapes”, que va ser proposat per Peter Armitage i Richard Doll el 1954, va abordar el càncer com a producte no només d’un, sinó de diversos esdeveniments cel·lulars. Aquests esdeveniments podien ser mutacions, com les induïdes per la radiació o per contaminants químics.
Si el càncer es podia entendre com una malaltia produïda per mutacions, aleshores resultava lògic considerar els productes carcinògens com els agents causants d’aquestes mutacions, d’aquí que rebessin el nom de mutàgens. Va ser aquesta línia de pensament la que va inspirar Bruce Ames, bioquímic de la Universitat de Califòrnia (Berkeley), per a desenvolupar el seu senzill assaig de laboratori mitjançant soques modificades de la bactèria Salmonella typhimirium. A mitjan dècada del 1970, el seu laboratori va analitzar una mostra de 300 substàncies químiques d’ús comú i va arribar a la conclusió que el 90% dels mutàgens de la Salmonella també eren carcinògens de rosegadors, així com que el 89% dels productes carcinògens provats en animals també eren mutàgens bacterians. El 1975, Bruce Ames i els seus col·laboradors van identificar molts tints per al cabell com a potencialment mutagènics, una troballa que va ser àmpliament descrita als mitjans de comunicació de l’època. A més, Arlene Blum i Bruce Ames també van investigar el caràcter mutagènic d’un producte retardant de flama agregat en aquell temps als pijames de la canalla amb la finalitat de —complir amb els estàndards de seguretat respecte a la inflamabilitat dels teixits. Posteriorment es va descobrir que aquesta substància —anomenada habitualment tris per simplificació del seu nom químic: fosfat de tris-1,3-dicloro-2-propil (TDCCP)— causava càncer en rosegadors. Quan la Comissió de Seguretat de Productes del Consumidor dels Estats Units va prohibir aquesta substància a la roba per a canalla va emprar com a prova els resultats de mutagenicitat obtinguts mitjançant el test d’Ames.

Fotografia de Bruce N. Ames el 2009. Wikimedia.
Com indica l’exemple del tris, la prova ràpida i econòmica dissenyada per Ames va esdevenir una eina de gran valor per a la toxicologia, la regulació dels tòxics i les ciències ambientals. També les companyies farmacèutiques el van adoptar per a identificar medicaments potencialment cancerígens. Des de 1962, la FDA va requerir proves rigoroses i anteriors a la comercialització per a aprovar tots els medicaments nous. Identificar possibles productes carcinògens abans de realitzar les costoses proves en animals era, sens dubte, un procediment avantatjós per a la indústria. A més, l’EPA i la FDA van començar a exigir dades del test d’Ames i d’altres proves de mutagenicitat similars per als nous pesticides i els additius alimentaris abans de la seua aprovació per al mercat. La comunitat científica i el personal funcionari del govern tenien l’esperança que l’ús generalitzat del test d’Ames permetés la detecció fiable i la regulació exhaustiva de tots els productes químics —ja n’hi havia prop de 60.000 al mercat a mitjan dècada dels setanta— per a disminuir o inclús eliminar la incidència de càncer per l’exposició ambiental a aquestes substàncies químiques perilloses.
Aquest somni tan prometedor no es va arribar a complir. Un número creixent de productes químics van ser assajats i van donar positiu com a mutàgens, molts més del que s’esperava inicialment, incloent-hi moltes substàncies d’origen natural. A més, les accions lobbístiques de la indústria van aconseguir impedir la inclusió d’un requisit de proves de mutagenicitat per a nous productes químics a la Llei de Control de Substàncies Tòxiques (TSCA) dels Estats Units aprovada el 1976. A pesar que aquesta normativa estava repleta del terme “proves”, els anys posteriors a la seua promulgació la majoria de les companyies químiques no van informar als informes previs a la comercialització sobre la mutagenicitat dels seus productes, ni tampoc van oferir resultats d’altres assajos similars amb indicis rellevants sobre la toxicologia i els perills per a la salut humana dels seus productes. D’altra banda, les agències federals que supervisen els productes químics (com l’EPA) es van encarregar de protegir la informació comercial confidencial. Les empreses van ser traçudes en considerar les dades de toxicitat com a part d’aquesta informació confidencial, la qual cosa els permetia evitar-ne la difusió pública. El 1997, la Fundació per a la Defensa del Medi Ambient (Environment Defense Fund), una organització creada trenta anys enrere per una coalició de científics i advocats per a combatre els efectes del DDT, va informar que hi havia una manca d’informació pública sobre les proves de toxicitat per a més de dues terceres parts dels 3.000 productes químics més venuts als Estats Units.
A la dècada del 1980, la comprensió del càncer com una malaltia desencadenada per mutacions, que havia estat tan central per a les polítiques de salut ambiental anteriors, es va transformar substancialment fins a situar-se en un marc disciplinar cada vegada més relacionat amb la genètica. El projecte del Genoma Humà va intensificar la cerca de mutacions associades amb un major risc de càncer, com les esdevingudes als gens BRCA i que podien associar-se amb el càncer de mama. Com a reflex d’aquestes tendències, la prevenció del càncer va passar a centrar-se en les fonts de risc en els estils de vida individuals, sovint a costa de l’atenció deguda als efectes de les exposicions a tòxics ambientals de caràcter involuntari. La comunitat mèdica i el personal encarregat de les polítiques de salut pública van afrontar el càncer, de manera creixent, en termes de factors de risc. Inclús les persones especialistes en salut ambiental van adoptar aquest canvi de perspectiva, en part gràcies a les noves possibilitats obertes per la nova toxicogenòmica que permetia estudiar les varietats genètiques particulars dels individus més susceptibles a l’acció dels productes tòxics.
Els opositors a la regulació industrial van mobilitzar amb destresa aquests nous models biològics de la carcinogènesi, especialment els relacionats amb la predisposició genètica, per a desviar l’atenció i evitar la possible culpabilitat de les substàncies contaminants i dels productes químics comercials com a causes potencials del càncer en humans. Alhora, s’ha produït un canvi en els fonaments explicatius dels efectes tòxics dels productes químics industrials. Aquest canvi s’ha produït en part pel creixent interès pels disruptors endocrins, unes substàncies que poden produir, inclús en quantitats petites, diversos tipus de càncer, sense que el seu mecanisme d’acció estigui relacionat amb la mutació.
El repàs pels primers anys d’ús del test d’Ames als Estats Units revela la forma com la comunitat científica i les autoritats reguladores van intentar utilitzar la ciència per a protegir la salut humana i el medi ambient, emprant els resultats d’aquesta prova per a controlar la circulació dels productes químics tòxics. La història també mostra que la indústria química va lluitar contra els nous requisits reguladors, sovint a través del que Robert Proctor ha anomenat trade association science, és a dir, ciència al servei d’interessos comercials. En aquest sentit, els debats sobre la prevenció del càncer mitjançant el control de productes químics potencialment mutagènics formaven part d’una controvèrsia molt més àmplia sobre els costos ambientals de la industrialització, incloent en ells també problemes globals com ara el canvi climàtic produït per una llarga dependència dels combustibles fòssils. En definitiva, el repàs de la millora del a protecció del medi ambient depèn en gran manera de la determinació del que es considera (o no) com a ciència, quines persones tenen accés a aquests sabers i la manera com aquest coneixement serveix (o no) per a il·luminar la presa de decisions en matèria de regulació de productes perillosos. S’ha vist en aquest treball que les proves estandarditzades són elements essencials, de gran rellevància per a aquesta qüestió, però no són tingudes prou en compte, tant en les ciències ambientals com en els processos de regulació.
Angela N. H. Creager
Princeton University
* Traducció: Judit Gil-Farrero
Com citar aquest article:
Creager, Angela N. H. El test d’Ames. Sabers en acció, 09-07-2025. https://sabersenaccio.iec.cat/el-test-dames/.
Per a saber-ne més
Pots ampliar la informació amb la bibliografia i recursos disponibles.
Lectures recomanades
Boudia, Soraya, Angela N. H. Creager, Scott Frickel, Nathalie Jas, Carsten Reinhardt, and Jody A. Roberts. 2022. Residues: Thinking Through Chemical Environments. Rutgers University Press.
Oreskes, Naomi and Erik M. Conway. 2010. Merchants of Doubt: How a Handful of Scientists Obscured the Truth on Issues from Tobacco Smoke to Global Warming. Bloomsbury.
Proctor, Robert. 1995. Cancer Wars: How Politics Shapes What We Know & Don’t Know about Cancer. Basic Books.
Estudis
Boudia, Soraya, and Jas, Nathalie. 2013. Toxicants, Health and Regulation Since 1945. London: Pickering & Chatto.
Brickman, Ronald, Sheila Jasanoff, and Thomas Ilgen. 1985. Controlling Chemicals: The Politics of Regulation in Europe and the United States. Cornell University Press.
Creager, Angela N. H. 2014. “The Political Life of Mutagens: A History of the Ames Test,” in Powerless Science? Science and Politics in a Toxic World, edited by Soraya Boudia and Nathalie Jas, 46–64. Berghahn Books.
Creager, Angela N. H. 2021. “To Test or Not to Test: Tools, Rules, and Corporate Data in U.S. Chemicals Regulation,” Science, Technology & Human Values 46, no. 5: 975–97 https://doi.org/10.1177/01622439211013373
Demortain, David. 2020. The Science of Bureaucracy: Risk Decision Making and the US Environmental Protection Agency. MIT Press.
Frickel, Scott. 2004. Chemical Consequences: Environmental Mutagens, Scientist Activism, and the Rise of Genetic Toxicology. Rutgers University Press.
Langston, Nancy. 2010. Toxic Bodies: Hormone Disruptors and the Legacy of DES. Yale University Press.
Markowitz, Gerald, and Rosner, David. 2002. Deceit and Denial: The Deadly Politics of Industrial Pollution. University of California Press.
Murphy, Michelle. 2006. Sick Building Syndrome and the Problem of Uncertainty: Environmental Politics, Technoscience, and Women Workers. Duke University Press.
Sellers, Christopher. 1997. Hazards of the Job: From Industrial Disease to Environmental Health Science. University of North Carolina Press.
Shostak, Sara. 2013. Exposed Science: Genes, the Environment, and the Politics of Population Health. University of California Press.
Vogel, Sarah A. 2013. Is It Safe? BPA and the Struggle to Define the Safety of Chemicals. University of California Press.
Fonts
Ames, Bruce N. 1973. “Carcinogens are Mutagens: Their Detection and Classification.” Environmental Health Perspectives 6: 115–18.
Ames, Bruce N., Harold O. Kammen, and Edith Yamasaki. 1975. “Hair Dyes Are Mutagenic: Identification or a Variety of Mutagenic Ingredients.” Proceedings of the National Academy of Sciences, USA 72, no. 6: 2423–27.
Ames, Bruce N., Joyce McCann, and Edith Yamasaki. 1975. “Methods for Detecting Carcinogens and Mutagens with the Salmonella/Mammalian-Microsome Mutagenicity Test.” Mutation Research 31: 347–64.
Carson, Rachel. 1962. Silent Spring. Houghton Mifflin.
Environmental Defense Fund. 1997. Toxic Ignorance: The Continuing Absence of Basic Health Testing for Top-selling Chemicals in the United States. https://www.edf.org/sites/default/files/243_toxicignorance_0.pdf
McCann, Joyce, Edmund Choi, Edith Yamasaki, and Bruce N. Ames. 1975. “Detection of Carcinogens as Mutagens in the Salmonella/microsome Test: Assay of 300 Chemicals.” Proceedings of the National Academy of Sciences, USA 72, no. 12: 5135–39.
Pàgines d'internet i altres recursos
The (Un)making of Environmental Carcinogens: https://unmakingenvironmentalcarcinogens.princeton.edu
Distillations podcast on the Ames test: https://sciencehistory.org/stories/distillations-pod/the-ames-test/