—La tragedia de la talidomida produjo una gran cantidad de víctimas, pero también avances en las regulaciones sobre control de medicamentos en todo el mundo.—
A pesar de permanecer comercializada menos de una década, la talidomida provocó más de 10.000 casos de una extraña enfermedad conocida como “focomelia” (de focos, foca, y melos, miembro), porque causaba graves malformaciones en recién nacidos cuyas madres habían consumido dicho fármaco durante el embarazo. La talidomida, como muchos otros compuestos, tenía la capacidad de atravesar la membrana placentaria y actuar así sobre el embrión en crecimiento. La mayor parte de víctimas nacían sin brazos o piernas y sus manos o pies presentaban forma de aleta desde los hombros o la pelvis.

Aproximadamente el 40% de los recién nacidos que nacían con malformaciones moría durante el primer año de vida. Diario de Zamora de Falange Española de las J.O.N.S., 27/11/1962, p. 5. Biblioteca Virtual de Prensa Histórica.
En la actualidad se presupone que los fármacos que llegan al mercado han superado infinidad de controles antes ser comercializados, pero los controles existentes a mediados del siglo XX distaban considerablemente de los patrones actuales. Otro factor a tener en cuenta es que estos estándares de control variaban de un país a otro, lo que explica en cierta medida el mayor número de víctimas en ciertos países como Alemania o España mientras que otros como Estados Unidos consiguieron evitar o minimizar el problema.
Los ensayos con talidomida realizados a principios de la década de 1950 parecían indicar que se trataba de un fármaco seguro y sin toxicidad. La compañía alemana Chemie Grünenthal, fundada en 1946, no tuvo problemas para comercializarlo en 1957 bajo el nombre de Contergan. Indicado para tratar el insomnio, las náuseas y otras molestias habituales durante las primeras etapas del embarazo, ofrecía la ventaja respecto a otros hipnóticos y barbitúricos de que una sobredosis accidental (o intencionada) no era mortal. Estos factores, impulsados por una potente campaña publicitaria en la que se destacaba la seguridad y facilidad de uso del fármaco, convirtieron a la talidomida en un éxito de ventas a principios de los años 60. Fue distribuida en más de 46 países bajo más de 80 nombres comerciales diversos. En algunos países, Grünenthal comercializó la talidomida directamente o a través de distribuidores (como en el caso de España), pero en otros, como Reino Unido y Australia, el fármaco se fabricó y fue comercializado por compañías independientes con licencia de la empresa alemana. En Estados Unidos, la farmacéutica Richardson-Merrell iba a ser la encargada de distribuir el fármaco bajo el nombre comercial de Kevadon. Sin embargo, la agencia norteamericana encargada del control de fármacos (Food and Drug Administration, FDA) no aprobó su distribución en el año 1961.
La singularidad de las regulaciones estadounidenses recaía en que oficiales del gobierno eran los encargados finales de aprobar o rechazar la incorporación de nuevos fármacos tras analizar los resultados obtenidos en los ensayos previos. En otras palabras, los fabricantes de medicamentos debían proporcionar pruebas claras de la seguridad y eficacia del fármaco antes de comercializarlo. Se trataba así de evitar casos como el acontecido en 1938, cuando más de un centenar de personas fallecieron debido a la preparación del elixir sulfanilamida, que contenía dietilenglicol como disolvente, un producto de elevada toxicidad. Cuando llegaron los informes acerca de la talidomida, la farmacóloga Frances Oldham Kelsey (1914-2015) llevaba pocos años trabajando en la FDA, pero contaba con una dilatada experiencia en investigaciones acerca de los efectos secundarios de los fármacos y había conocido de primera mano la tragedia antes mencionada. Al poco tiempo de entrar en la agencia, fue encomendada con la misión de evaluar la talidomida (Kevadon), tarea que no parecía excesivamente complicada, a juzgar por la cantidad de países que ya la habían incorporado a su farmacopea. Contra todo pronóstico, Frances Kelsey, gracias a los saberes reunidos en su etapa como investigadora, editora y profesora, se convirtió en la indudable protagonista del rechazo a la comercialización de la talidomida en Estados Unidos a pesar de las presiones ejercidas por la industria farmacéutica, un sector que apuntaba al éxito que las diversas presentaciones del fármaco estaban obteniendo a nivel mundial.
La falta de datos sobre los métodos usados para determinar la calidad y pureza de la talidomida fueron motivos suficientes para que Kelsey y otros dos revisores de la FDA dudaran de su supuesta seguridad. Dejando a un lado los intereses económicos, a su juicio parecía bastante claro que los datos sobre toxicidad crónica y los efectos a largo plazo eran, cuando menos, incompletos. Mientras ese tira y afloja entre la industria y la FDA se producía, comenzaron a conocerse casos de anomalías congénitas en recién nacidos al otro lado del océano Atlántico.
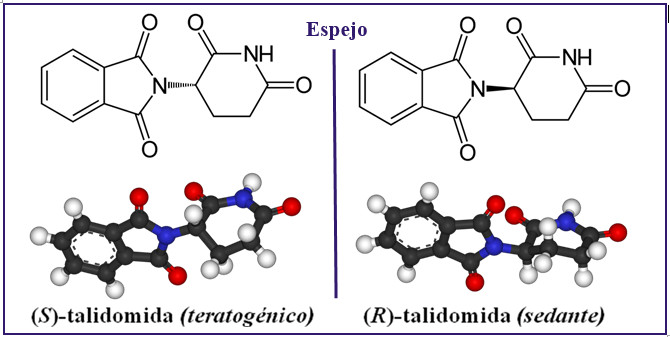
Los principios activos de muchos medicamentos están formados por moléculas que son quirales (del griego kéir, mano) llamadas enantiómeros. En la molécula de talidomida, el enantiómero R es responsable de su efecto sedante, mientras que el enantiómero S produce efectos teratógenos. NUCLEUS, Universidad de Salamanca.
El súbito incremento de casos de recién nacidos con malformaciones alertó a médicos de diferentes países. A pesar de ello, varios factores dificultaron la asociación entre el fármaco y sus efectos nocivos: la venta de la talidomida sin receta médica, el reparto de muestras entre las pacientes, una práctica permitida y parte de la campaña publicitaria que realizó Grünenthal, y la forma de gestión de las historias clínicas a mediados del siglo XX. Se buscaron otras potenciales causas de las malformaciones. El pediatra y genetista alemán Widukind Lenz (1919-1995), que entonces trabajaba en el Hospital de la Universidad de Hamburgo, pensó en orígenes genéticos, pero descartó la idea al comprobar que los casos aparecían en familias sin antecedentes. Lenz elaboró entonces una historia clínica más detallada de sus pacientes y de las de otras clínicas del entorno. Recogió detalles sobre su alimentación y fármacos consumidos durante el embarazo. El Contergan fue el punto de conexión entre todas estas historias clínicas: todas las embarazadas habían consumido talidomida entre los días 37 y 50 de la gestación.
Lenz se puso en contacto con la farmacéutica Grünenthal y les trasladó su preocupación por los datos observados. La noticia de que algo sucedía con el fármaco se diseminó rápidamente en la prensa médica y general. La revista The Lancet publicó una carta de un obstetra australiano, William-Griffith McBride (1927-2018), en la que también se señalaba la más que probable relación entre la focomelia y el consumo del fármaco. Ante estas pruebas, Grünenthal, sin dar demasiadas explicaciones, decidió suspender la comercialización de su producto estrella en territorio alemán a finales de noviembre de 1961, acción que fue seguida en el resto del mundo durante 1962 y 1963.
En 1968 comenzó el denominado proceso Contergan, que se prolongó durante casi tres años hasta convertirse en uno de los más largos de la historia del derecho alemán. Este juicio planteó problemas de legitimidad y credibilidad para los peritos semejantes a los que se han señalado en otros apartados de Saberes en acción. El enfrentamiento de Widukind Lenz con la industria farmacéutica se convirtió en una batalla con tintes personales en la que fue acusado de falta de neutralidad y de objetividad con respecto a los datos obtenidos. En un intento de no perder su prestigio, la compañía Grünenthal ofreció crear un fondo económico con el fin de indemnizar a los afectados por el fármaco, evitando un pronunciamiento condenatorio. En 2012, el laboratorio pidió oficialmente disculpas, pero sin variar demasiado el discurso según el cual afirmaban que en el momento de su comercialización habían realizado todos los ensayos posibles.

Escultura de bronce que representa a una niña sin brazos y con una malformación en los pies, sentada en una silla, y otra vacía, con la que la compañía Grünenthal rindió homenaje a las víctimas en 2012. AVITE.
Los daños provocados por la talidomida en España se agravaron por la falta de atención que se prestó al problema. Las víctimas fueron olvidadas durante décadas, a pesar de ser uno de los países donde se vendieron más fármacos de este tipo y en el que se estima que se encuentra un número elevado de afectados todavía vivos. La indefensión de las víctimas en los tribunales se ha visto condicionada por las peculiaridades de la comercialización del fármaco en el territorio español, dado que el principio activo se empleó en seis preparaciones diferentes, distribuidas por varias empresas farmacéuticas. Gracias a esta situación, Grünenthal puede requerir judicialmente pruebas de difícil cumplimiento para poder justificar la relación de las víctimas con su fármaco, por ejemplo, presentar un recipiente del medicamento o de la receta médica en los juicios celebrados medio siglo después del problema.

Softenon fue uno de los nombres con los que se comercializó la talidomida en España. AVITE.
Un juzgado de primera instancia de Madrid sentenció en 2013 a la farmacéutica Grünenthal a pagar indemnizaciones a 180 personas a razón de 20.000 euros por cada punto porcentual de minusvalía reconocida. Sin embargo, con inusual rapidez, en menos de un año, la Audiencia de Madrid anuló la sentencia al considerar que los delitos habían prescrito. La sentencia fue recurrida, pero el Tribunal Supremo en 2015, el Tribunal Constitucional en 2016 y, finalmente, el Tribunal Europeo de Derechos Humanos en 2017 desestimaron la demanda de los afectados, poniendo así un indignante punto final a la posibilidad de obtener reparaciones por vía judicial. Los decretos aprobados para establecer compensaciones por parte del Estado no han producido los resultados demandados por las asociaciones de víctimas, que, todavía en la actualidad, siguen reclamando justicia.

Representados por la Asociación de Víctimas de la Talidomida (AVITE), los afectados en España continúan reclamando indemnizaciones a nivel estatal e internacional. José Luis Roca, El Periódico.
Desde el punto de vista farmacológico, las consecuencias de la catástrofe de la talidomida son especialmente relevantes. Provocaron la aparición de regulaciones mucho más estrictas sobre seguridad en el uso de medicamentos en todo el mundo. En Estados Unidos se aprobó en 1962 una adición a la Food, Drug and Cosmetic Act según la cual se aumentaban las exigencias antes de autorizar un nuevo medicamento. Se obligaba a los fabricantes a comunicar cualquier efecto adverso no esperado de los productos comercializados. Además, se revisaron retrospectivamente más de 7.000 productos que la FDA había autorizado previamente y se retiraron por ineficaces alrededor de dos de cada tres de ellos. La eficacia pasó a ser un requisito indispensable para la aprobación de nuevos medicamentos. En 1964, en el Reino Unido se creó el Committe of Safety Drugs, que solicitaba la colaboración voluntaria de los fabricantes de fármacos para comunicar cualquier reacción adversa de los medicamentos. La Organización Mundial de la Salud creó el Collaborating Center for International Drug Monitoring para estudiar las comunicaciones de los potenciales efectos adversos de los medicamentos. En pocos años, la mayoría de los países revisaron y fortalecieron sus leyes acerca de los medicamentos, y la farmacovigilancia surgió como una práctica de salud pública para detectar, evaluar, investigar y prevenir los efectos de medicamentos, productos biológicos, plantas medicinales y medicinas tradicionales, con el objetivo final de contar con sistemas de detección precoz de los efectos indeseados de los medicamentos, que permitirían actuar si aparecía algún problema imprevisto de seguridad.
Desde la perspectiva de las víctimas, sin embargo, la tragedia de la talidomida muestra las dificultades para reclamar la responsabilidad penal de las compañías farmacéuticas que comercializaron el producto y conseguir así reparaciones económicas y morales por los daños sufridos. El ejemplo de la talidomida muestra que los beneficios de la industria farmacéutica se contraponen en ocasiones al derecho a la salud y, por ello, señala la necesidad de contar con agencias de control y técnicos independientes con capacidad de enfrentarse a poderosos intereses.
Mar Cuenca Lorente
IILP-UV
Para saber más
Puedes ampliar la información con la bibliografía y recursos disponibles.
Lecturas recomendadas
Dumit, Joseph. Drugs for life: how pharmaceutical companies define our health.Durham, NC: Duke University Press; 2012.
Estudios
Golan, Tal. Laws of Man and Laws of Nature: A History of Scientific Expert Testimony. Cambridge: Harvard University Press, 2004.
Goldacre, Ben. Bad Pharma: How drug companies mislead doctors and harm patients. London: Fourth State; 2012.
McFayden, Richard. Thalidomide in America: a brush with tragedy. Clio Medica. 1976; 11: 19-93.
Mossialos, Elias; Mrazek, Monique; Walley, Tom. Regulating pharmaceutical in Europe. London: Open University Press; 2004.
Navarro-Michel, Mónica. Daños causados por la Talidomida: la batalla legal que no cesa. Comentario a la STS de 20 de octubre de 2015. Revista de Bioética y Derecho. 2016; 37: 133-148.
Scheindlin, Stanley. The courage of one’s convictions: The due diligence of Frances Oldham Kelsey at the FDA. Molecular Interventions. 2011, 11 (1): 3-9.
Sjöström, Henning; Nilsson, Robert. Thalidomide and the power of the drug companies. Harmmsworth: Penguin; 1972.
Weatheral, Miles. Drug treatment and the rise in pharmacology. In: Porter, Roy,eds. The Cambridge Illustrated History of Medicine. Cambridge: The Cambridge University Press. 1996; 246-277.
Vaquero Pinto, María José. Historia del caso de la Talidomida. Dies a quo del plazo de prescripción de la acción de responsabilidad civil. Prescripción y amparo constitucional. Derecho Privado y Constitución. 2017; 31: 275-316.
Páginas de internet y otros recursos
Documental Talidomida caso pendiente. Disponible en este enlace.
Grünenthal. Thalidomide-tragedy.com. Disponible en este enlace.



