—La tragèdia de la talidomida va produir una gran quantitat de víctimes, però també avenços en les regulacions sobre control de medicaments a tot el món.—
A pesar de romandre comercialitzada menys d’una dècada, la talidomida va provocar més de 10.000 casos d’una estranya malaltia coneguda com a “focomèlia” (de focos, foca, i melos, membre), perquè causava greus malformacions en nounats les mares dels quals havien consumit aquest fàrmac durant l’embaràs. La talidomida, com molts altres compostos, tenia la capacitat de travessar la membrana placentària i actuar així sobre l’embrió en creixement. La major part de les víctimes naixien sense braços o cames i les seves mans o peus presentaven forma d’aleta des del muscle o la pelvis.

Aproximadament el 40% dels nounats que naixien amb malformacions moria durant el primer any de vida. Diario de Zamora de Falange Española de las J.O.N.S., 27/11/1962, p. 5. Biblioteca Virtual de Prensa Histórica.
Actualment es pressuposa que els fàrmacs que arriben al mercat han superat infinitat de controls abans de ser comercialitzats, però els controls existents a mitjan segle XX distaven considerablement dels patrons actuals. Un altre factor a tenir en compte és que aquests estàndards de control variaven d’un país a un altre, la qual cosa explica en certa manera el major número de víctimes en certs països com Alemanya o Espanya mentre que altres com els Estats Units van aconseguir evitar o minimitzar el problema.
Els assajos amb talidomida realitzats a principis de la dècada del 1950 semblaven indicar que es tractava d’un fàrmac segur i sense toxicitat. La companyia alemanya Chemie Grünenthal, fundada el 1946, no va tenir problemes per comercialitzar-lo el 1957 sota el nom de Contergan. Indicat per tractar l’insomni, les nàusees i altres molèsties habituals durant les primeres etapes de l’embaràs, oferia l’avantatge respecte altres hipnòtics i barbitúrics que una sobredosi accidental (o intencionada) no era mortal. Aquests factors, impulsats per una potent campanya publicitària en què es destacava la seguretat i facilitat d’ús del fàrmac, van convertir la talidomida en un èxit de vendes a principis dels anys seixanta. Va ser distribuïda en més de 46 països sota més de 80 noms comercials diversos. En alguns països, Grünenthal va comercialitzar la talidomida directament o a través de distribuïdors (com en el cas d’Espanya), però en d’altres, com Regne Unit i Austràlia, el fàrmac es va fabricar i va ser comercialitzat per companyies independents amb llicència de l’empresa alemanya. Als Estats Units, la farmacèutica Richardson-Merrell seria l’encarregada de distribuir el fàrmac sota el nom comercial de Kevadon. Tanmateix, l’agència nord-americana encarregada del control de fàrmacs (Food and Drug Administration, FDA) no en va aprovar la distribució el 1961.
La singularitat de les regulacions estatunidenques requeia en què oficials del govern eren els encarregats finals d’aprovar o rebutjar la incorporació de nous fàrmacs després d’analitzar els resultats obtinguts als assajos previs. En altres paraules, els fabricants de medicaments havien de proporcionar proves clares de la seguretat i eficàcia del fàrmac abans de comercialitzar-lo. Es tractava així d’evitar casos com el succeït el 1938, quan més d’un centenar de persones van morir degut a la preparació de l’elixir sulfanilamida, que contenia dietilenglicol com a dissolvent, un producte d’elevada toxicitat. Quan van arribar els informes sobre la talidomida, la farmacòloga Frances Oldham Kelsey (1914-2015) portava pocs anys treballant a la FDA, però comptava amb una dilatada experiència en recerques sobre els efectes secundaris dels fàrmacs i havia conegut de primera mà la tragèdia abans esmentada. Poc temps després d’entrar a l’agència, li van encomanar la missió d’avaluar la talidomida (Kevadon), tasca que no semblava excessivament complicada, si s’havia de jutjar per la quantitat de països que ja l’havien incorporat a la seva farmacopea. Contra tot pronòstic, Frances Kelsey, gràcies als sabers reunits en la seva etapa com a investigadora, editora i professora, es va convertir en la indubtable protagonista del rebuig a la comercialització de la talidomida als Estats Units malgrat les pressions exercides per la indústria farmacèutica, un sector que apuntava a l’èxit que les diverses presentacions del fàrmac estaven obtenint a nivell mundial.
La manca de dades sobre els mètodes usats per determinar la qualitat i la puresa de la talidomida van ser motius suficients perquè Kelsey i dos altres revisors de la FDA dubtessin de la seva suposada seguretat. Deixant de banda els interessos econòmics, al seu entendre semblava força clar que les dades sobre toxicitat crònica i els efectes a llarg termini eren, si més no, incomplets. Mentre aquest estira-i-arronsa entre la indústria i la FDA es produïa, es van començar a conèixer casos d’anomalies congènites en nounats a l’altra banda de l’oceà Atlàntic.
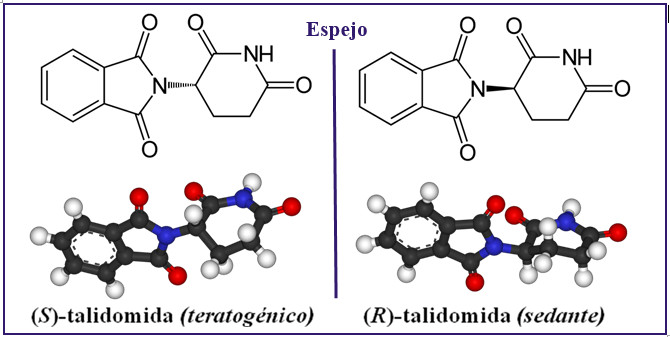
Els principis actius de molts medicaments estan formats per molècules que són quirals (del grec kéir, mà) anomenades enantiòmers. A la molècula de talidomida, l’enantiòmer R és responsable del seu efecte sedant, mentre que l’enantiòmer S produeix efectes teratògens. NUCLEUS, Universidad de Salamanca.
El sobtat increment de casos de nounats amb malformacions va alertar metges de diferents països. Malgrat això, diversos factors van dificultar l’associació entre el fàrmac i els seus efectes nocius: la venda de la talidomida sense recepta mèdica, el repartiment de mostres entre les pacients, una pràctica permesa i part de la campanya publicitària que va realitzar Grünenthal, i la forma de gestió de les històries clíniques a mitjan segle XX. Es van buscar altres potencials causes de les malformacions. El pediatra i genetista alemany Widukind Lenz (1919-1995), que aleshores treballava a l’Hospital de la Universitat d’Hamburg, va pensar en orígens genètics, però va descartar la idea en comprovar que els casos apareixen en famílies sense antecedents. Lenz va elaborar llavors una història clínica més detallada de les seves pacients i de les d’altres clíniques del voltant. Va recollir detalls sobre la seva alimentació i fàrmacs consumits durant l’embaràs. El Contergan va ser el punt de connexió entre totes aquestes històries clíniques: totes les embarassades havien consumit talidomida entre els dies 37 i 50 de la gestació.
Lenz es va posar en contacte amb la farmacèutica Grünenthal i els va traslladar la seva preocupació per les dades observades. La notícia que alguna cosa succeïa amb el fàrmac es va disseminar ràpidament a la premsa mèdica i general. La revista The Lancet va publicar una carta d’un obstetra australià, William-Griffith McBride (1927-2018), en la qual també s’assenyalava la més que probable relació entre la focomèlia i el consum del fàrmac. Davant aquestes proves, Grünenthal, sense donar massa explicacions, va decidir suspendre la comercialització del seu producte estrella al territori alemany a finals de novembre de 1961, acció que va ser seguida a la resta del món durant 1962 i 1963.
El 1968 va començar el denominat procés Contergan, que es va prolongar durant gairebé tres anys fins a convertir-se en un dels més llargs de la història del dret alemany. Aquest judici va plantejar problemes de legitimitat i credibilitat per als perits semblants als que s’han assenyalat en altres apartats de Sabers en acció. L’enfrontament de Widukind Lenz amb la indústria farmacèutica es va convertir en una batalla amb tints personals en què va ser acusat de falta de neutralitat i d’objectivitat respecte a les dades obtingudes. En un intent de no perdre el seu prestigi, la companyia Grünenthal va oferir crear un fons econòmic amb el fi d’indemnitzar els afectats pel fàrmac per evitar un pronunciament condemnatori. El 2012, el laboratori va demanar oficialment disculpes, però sense variar massa el discurs segons el qual afirmaven que en el moment de la seva comercialització havien realitzat tots els assajos possibles.

Escultura de bronze que representa una nena sense braços i amb una malformació als peus, asseguda en una cadira, i una altra buida, amb la que la companyia Grünenthal va retre homenatge a les víctimes el 2012. AVITE.
Els danys provocats per la talidomida a Espanya es van agreujar per la manca d’atenció que es va prestar al problema. Les víctimes van ser oblidades durant dècades, malgrat ser un dels països on es van vendre més fàrmacs d’aquest tipus i en el que s’estima que es troba un nombre elevat d’afectats encara vius. La indefensió de les víctimes als tribunals s’ha vist condicionada per les peculiaritats de la comercialització del fàrmac al territori espanyol, atès que el principi actiu es va emprar en sis preparacions diferents, distribuïdes per diverses empreses farmacèutiques. Gràcies a aquesta situació, Grünenthal pot requerir judicialment proves de difícil compliment per poder justificar la relació de les víctimes amb el seu fàrmac, per exemple, presentar un recipient del medicament o de la recepta mèdica als judicis celebrats mig segle després del problema.

Softenon va ser un dels noms amb els que es va comercialitzar la talidomida a Espanya. AVITE.
Un jutjat de primera instància de Madrid va sentenciar el 2013 a la farmacèutica Grünenthal a pagar indemnitzacions a 180 persones a raó de 20.000 euros per cada punt percentual de minusvalidesa reconeguda. Tanmateix, amb inusual rapidesa, en menys d’un any, l’Audiència de Madrid va anul·lar la sentència en considerar que els delictes havien prescrit. La sentència va ser recorreguda, però el Tribunal Suprem el 2015, el Tribunal Constitucional el 2016 i, finalment, el Tribunal Europeu de Drets Humans el 2017 van desestimar la demanda dels afectats, posant així un indignant punt final a la possibilitat d’obtenir reparacions per via judicial. Els decrets aprovats per establir compensacions per part de l’Estat no han produït els resultats demandats per les associacions de víctimes, que, encara actualment, segueixen reclamant justícia.

Representats per la Asociación de Víctimas de la Talidomida (AVITE), els afectats a Espanya continuen reclamant indemnitzacions a nivell estatal i internacional. José Luis Roca, El Periódico.
Des del punt de vista farmacològic, les conseqüències de la catàstrofe de la talidomida són especialment rellevants. Van provocar l’aparició de regulacions molt més estrictes sobre seguretat en l’ús de medicaments a tot el món. Als Estats Units es va aprovar el 1962 una addició a la Food, Drug and Cosmetic Act segons la qual s’augmentaven les exigències abans d’autoritzar un nou medicament. S’obligava els fabricants a comunicar qualsevol efecte advers no esperat dels productes comercialitzats. A més, es van revisar retrospectivament més de 7.000 productes que la FDA havia autoritzat prèviament i se’n van retirar per ineficaços al voltant de dos de cada tres d’ells. L’eficàcia va passar a ser un requisit indispensable per a l’aprovació de nous medicaments. El 1964, al Regne Unit es va crear el Committe of Safety Drugs, que sol·licitava la col·laboració voluntària dels fabricants de fàrmacs per comunicar qualsevol reacció adversa dels medicaments. L’Organització Mundial de la Salut va crear el Collaborating Center for International Drug Monitoring per estudiar les comunicacions dels potencials efectes adversos dels medicaments. En pocs anys, la majoria dels països van revisar i enfortir les seves lleis sobre els medicaments, i la farmacovigilància va sorgir com una pràctica de salut pública per detectar, avaluar, investigar i prevenir els efectes dels medicaments, productes biològics, plantes medicinals i medicines tradicionals, amb l’objectiu final de comptar amb sistemes de detecció precoç dels efectes indesitjats dels medicaments, que permetrien actuar si apareixia algun problema imprevist de seguretat.
Des de la perspectiva de les víctimes, tanmateix, la tragèdia de la talidomida mostra les dificultats per reclamar la responsabilitat penal de les companyies farmacèutiques que van comercialitzar el producte i aconseguir així reparacions econòmiques i morals pels danys patits. L’exemple de la talidomida mostra que els beneficis de la indústria farmacèutica es contraposen en ocasions al dret a la salut i, per això, assenyala la necessitat de comptar amb agències de control i tècnics independents amb capacitat d’enfrontar-se a poderosos interessos.
Mar Cuenca Lorente
IILP-UV
Per a saber-ne més
Pots ampliar la informació amb la bibliografia i recursos disponibles.
Lectures recomanades
Daemmrich, Arthur. A tale of two experts: Thalidomide and Political Engagement in the United States and West Germany. Social History of Medicine. 2002; 15 (1): 137-158.
Dumit, Joseph. Drugs for life: how pharmaceutical companies define our health.Durham, NC: Duke University Press; 2012.
Estudis
Del Castillo Rodríguez, Carlos; Motorga, Ema Delia; Lozano Estevan, María Jesús; Basante Pol, R. La talidomida en España según ABC y La Vanguardia Española (1957-1963). In: Moreno Toral, Esteban; Ramos Carrillo, Antonio; González Bueno, Antonio, eds. Ciencia y profesión: el farmacéutico en la historia. Sevilla: Universidad Internacional de Andalucía; 2018, p. 431- 444.
Golan, Tal. Laws of Man and Laws of Nature: A History of Scientific Expert Testimony. Cambridge: Harvard University Press, 2004.
Goldacre, Ben. Bad Pharma: How drug companies mislead doctors and harm patients. London: Fourth State; 2012.
McFayden, Richard. Thalidomide in America: a brush with tragedy. Clio Medica. 1976; 11: 19-93.
Mossialos, Elias; Mrazek, Monique; Walley, Tom. Regulating pharmaceutical in Europe. London: Open University Press; 2004.
Navarro-Michel, Mónica. Daños causados por la Talidomida: la batalla legal que no cesa. Comentario a la STS de 20 de octubre de 2015. Revista de Bioética y Derecho. 2016; 37: 133-148.
Scheindlin, Stanley. The courage of one’s convictions: The due diligence of Frances Oldham Kelsey at the FDA. Molecular Interventions. 2011, 11 (1): 3-9.
Sjöström, Henning; Nilsson, Robert. Thalidomide and the power of the drug companies. Harmmsworth: Penguin; 1972.
Weatheral, Miles. Drug treatment and the rise in pharmacology. In: Porter, Roy,eds. The Cambridge Illustrated History of Medicine. Cambridge: The Cambridge University Press. 1996; 246-277.
Vaquero Pinto, María José. Historia del caso de la Talidomida. Dies a quo del plazo de prescripción de la acción de responsabilidad civil. Prescripción y amparo constitucional. Derecho Privado y Constitución. 2017; 31: 275-316.
Pàgines d’internet i altres recursos
AVITE, Asociación de víctimas de la talidomida en España. Disponible en aquest enllaç.
Documental Talidomida caso pendiente. Disponible en aquest enllaç.
Grünenthal. Thalidomide-tragedy.com. Disponible en aquest enllaç.



